您现在的位置是: 首页 > 热门院校 热门院校
高考化学难题_高考化学难题精选解析?
tamoadmin 2024-06-12 人已围观
简介1.你好,您能帮我解决高考化学难题吗.我实在很需要你的帮助呀2.化学难题求解答3.求高一化学(上)一些有关守恒的计算题4.高一化学 选择题 解答过程?5.高考化学答题技巧有哪些1.不加其它试剂就无法鉴别的一组无色溶液是: A.NH4NO3、Na2SO4、CuSO4、MgCl2 B.MgCl2、BaCl2、NaOH、H2SO4 C.NaBr、AgNO3、HCl、KI D.NaNO3、BaCl
1.你好,您能帮我解决高考化学难题吗.我实在很需要你的帮助呀
2.化学难题求解答
3.求高一化学(上)一些有关守恒的计算题
4.高一化学 选择题 解答过程?
5.高考化学答题技巧有哪些
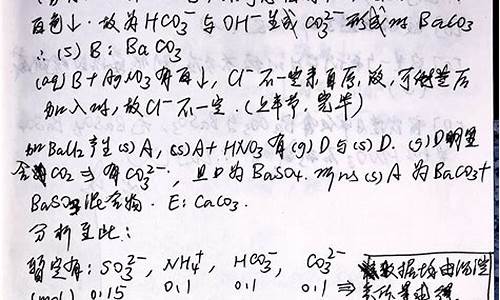
1.不加其它试剂就无法鉴别的一组无色溶液是:
A.NH4NO3、Na2SO4、CuSO4、MgCl2
B.MgCl2、BaCl2、NaOH、H2SO4
C.NaBr、AgNO3、HCl、KI
D.NaNO3、BaCl2、Na2CO3、H2SO4.
理由
你好,您能帮我解决高考化学难题吗.我实在很需要你的帮助呀
高考化学注意事项和细节有注意审题、注意书写、区分物质状态、答题要全面、化学计算常犯错误要牢记、不要得意忘形。
一、注意审题:
排列顺序时,分清是“由大到小”还是“由小到大”,类似地,看清“由强到弱”还是“由高到低”。特别注意选择题的指向性是“正确的是”还是“错误的是”两种不同要求。
二、注意书写:
1、化学方程式:
书写化学方程式时,分清写等号还是可逆符号,如盐水解方程式要用可逆符号。有单位的要写单位,没有单位的就不写。如“溶解度”单位是g,摩尔质量的单位为g/mol等等,若不写单位就失分。单位要用字母表示,不能用汉字表示。
2、名称问题:
要求写“名称”要用汉字写,不能写分子式或其他化学式。写电子式、原子或离子结构示意图、结构简式、结构式、离子方程式等要看清,防止张冠李戴。
三、区分物质状态:
注意三氧化硫、乙烷、水、氟化氢等物质的状态。区分液态氯化氢和盐酸,液氨和氨水,液氯和氯水等。
四、答题要全面:
描述实验现象要全面,要“陆、海、空”全方位进行。避免简单化,一叶障目。不要混淆离子电荷与元素化合价,原电池正负极,电解池、电镀池阴阳极等。对推断题,要根据题意,无机物、有机物均应全面,综合考虑。注意关键词和关键步骤。
五、化学计算常犯错误要牢记:
化学方程式写错或不配平或配平有错;用关系式计算时,物质的量忽略了部分取用关系;计算结果一定要准确,注意题中对有效数字的隐性要求;如只要求列出计算式,不需要带上计算结果。
六、不要得意忘形:
遇到做过的类似题,一定不要得意忘形,要认真读题,找出关键词,寻找突破口,不要思维定式;碰到难题更要镇静,要知道,难大家都难。应注意的是,难度大的试题中也有易得分的小题,应该通过读题解题得到这些小分。
化学难题求解答
2CnH2n+3nO2=2nCO2+2nH2O -------体积增加,
2 3n 2n 2n 2n+2n-3n-2=n-2
100 100
得n-2=2
n=4
所以烯烃的分子式为C4H8。
结构式为:
| | | |
-C-C=C-C-
| | | |
因为...两种信号
如C=C-C-C则有四种信号
求高一化学(上)一些有关守恒的计算题
1) 量筒、烧杯
2)
NaOH + HCl = NaCl + H2O
40 36.5
8*1% x
x=0.073g
0.073/20=0.365%
高一化学 选择题 解答过程?
难点1 .守恒法 守恒法是高考中常考常用的一种解题方法。系统学习守恒法的应用,对提高解题速率和破解高考难题都有很大的帮助。●难点磁场请试做下列题目,然后自我界定学习本篇是否需要。现有19.7 g由Fe、FeO、Al、Al2O3组成的混合物,将它完全溶解在540 mL 2.00 mol·L-1的H2SO4溶液中,收集到标准状况下的气体8.96 L。已知混合物中,Fe、FeO、Al、Al2O3的质量分数分别为0.284、0.183、0.274和0.259。欲使溶液中的金属阳离子完全转化为氢氧化物沉淀,至少应加入2.70 mol·L-1的NaOH(aq)体积是________。●案例探究[例题]将 CaCl2 和 CaBr2 的混合物 13.400 g溶于水配成 500.00 mL 溶液,再通入过量的 Cl2,完全反应后将溶液蒸干,得到干燥固体 11.175 g。则原配溶液中,c(Ca2+)∶c(Cl-)∶c(Br-)为A.3∶2∶1 B.1∶2∶3 C.1∶3∶2 D.2∶3∶1命题意图:考查学生对电荷守恒的认识。属化学教学中要求理解的内容。知识依托:溶液等有关知识。错解分析:误用电荷守恒:n(Ca2+ )= n(Cl-) + n(Br-),错选A。解题思路:1个 Ca2+ 所带电荷数为2,则根据溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,知原溶液中:2n(Ca2+) = n (Cl-) + n (Br-)将各备选项数值代入上式进行检验可知答案。答案:D●锦囊妙计化学上,常用的守恒方法有以下几种:1.电荷守恒溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数。即:阳离子物质的量(或浓度)与其所带电荷数乘积的代数和等于阴离子物质的量(或浓度)与其所带电荷数乘积的代数和。2.电子守恒化学反应中(或系列化学反应中)氧化剂所得电子总数等于还原剂所失电子总数。3.原子守恒系列反应中某原子(或原子团)个数(或物质的量)不变。以此为基础可求出与该原子(或原子团)相关连的某些物质的数量(如质量)。4.质量守恒包含两项内容:①质量守恒定律;②化学反应前后某原子(或原子团)的质量不变。此外,还有物料平衡,将编排在第16篇——水的电离中。●歼灭难点训练1.(★★★)将 3.48 g Fe3O4 完全溶解在 100 mL 1.00 mol/L 的 H2SO4(aq) 中,然后加入 K2Cr2O7(aq)25.00 mL,恰好使 Fe2+全部转化为 Fe3+,且 Cr2O 全部转化为 Cr3+。则 K2Cr2O7 的物质的量浓度为__________。2.(★★★)某露置的苛性钾经分析含水:7.62%(质量分数,下同)、K2CO3:2.38%、KOH :90.00%。取此样品 1.00 g 放入 46.00 mL 1.00 mol·L-1 的 HCl(aq) 中,过量的 HCl 可用 1.070 mol/L KOH(aq)中和至中性,蒸发中和后的溶液可得固体_______克。3.(★★★★)A、B、C三种物质各15 g,发生如下反应:A+B+C D反应后生成D的质量为30 g。然后在残留物中加入10 g A,反应又继续进行,待反应再次停止,反应物中只剩余C,则下列说法正确的是( )A.第一次反应停止时,剩余B 9 gB.第一次反应停止时,剩余C 6 gC.反应中A和C的质量比是5∶3D.第二次反应后,C剩余5 g4.(★★★★★)(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO摩尔质量为74.7 g·mol-1)。 图1—1(2)天然的和绝大部分人工制备的晶体,都存在各种缺陷,例如在某种NiO晶体中就存在如图1—1所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。附:参考答案难点磁场提示:根据 Na 原子守恒和 SO 守恒得如下关系:2NaOH ~ Na2SO4~ H2SO4则:n(NaOH) = 2n(H2SO4)c(NaOH)·V [NaOH(aq)] = 2c(H2SO4)·V [H2SO4(aq)]V [NaOH(aq)]可求。答案:800 mL歼灭难点训练1.提示:Fe3O4中 +2 价铁所失电子物质的量与 Cr2O 中+6 价铬所得电子物质的量相等。×(3-2)= 0.02500 L×c(Cr2O )×(6-3)×2。答案:0.100 mol·L-12.提示:根据 Cl 原子守恒得:n(KCl) = n(HCl) = 1.00 mol·L-1×0.04600 L = 4.60×10-2 mol,m(KCl) 易求。答案:3.43 g3.解析:第一次反应 A 不足,因为第一次反应后加入 A 又能进行第二次反应。第二次反应后,只剩余 C,说明 A、B 恰好完全反应。则:m反(A)∶m反(B) = (15 g+10 g)∶15 g = 5∶3第一次反应耗 B 的质量mB为:15 g∶mB=5∶3,mB=9 g即第一次反应后剩余B质量为:15 g-9 g=6 g。可见(A)选项不正确。根据mA+mB+mC=mD ,可知生成30 g D时消耗C的质量。mC=30 g-15 g-9 g=6 g即第一次反应后剩余C质量为:15 g-6g=9g。又见(B)选项不正确。易见反应消耗A、B、C质量之比为:mA∶mB∶mC=15 g∶9 g∶6g=5∶3∶2(C)选项不正确。答案:D4.提示:由题得 NiO 晶体结构(如右图)。其体积为:V = (a×10-8cm)3右图向三维空间延伸,它平均拥有的 Ni2+、O2-数目为:N(Ni2+) =N(O2-) = ×4 = =N(NiO)由密度公式得:ρ(NiO) = 。(2)(电荷守恒法)设 1 mol Ni0.97O 中含Ni3+物质的量为x,则Ni2+的物质的量为(0.97 mol-x);根据电荷守恒得:3x+2×(0.97 mol-x)=1 mol×2 x=0.06 molN(Ni3+)∶N(Ni2+)=0.06 mol∶(0.97 mol-0.06 mol)=6∶91答案:(1) (2)6∶91 慢慢理解吧 我现在高二 化学一定要学好 谢谢采纳
高考化学答题技巧有哪些
分析:铝与铁和硝酸反应,且整个过程中没有气体放出,说明所有的产物全在溶液中。根据反应的过程可推断后应后溶液中的溶质包括:Al(NO3)3 Fe(NO3)3 NH4NO3(因为没有气体产生,所以产物应该是硝酸铵) HNO3(从图象可以看出OC这一段没有沉淀产生,说明发生的是酸碱中和,所以硝酸有剩余,硝酸有剩余更反证铁与硝酸反应得到的是硝酸铁,而不是铁过量的产物硝酸亚铁)
则图象中各段反应:
OC段:酸碱中和,HNO3 + NaOH = NaNO3 + H2O
CD段:产生沉淀,Al(NO3)3 + 3NaOH = Al(OH)3 ↓+ 3NaNO3
Fe(NO3)3 + 3NaOH = Fe(OH)3 ↓+ 3NaNO3
DE段:硝酸铵与氢氧化钠反应,NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
离子方程式:NH4+ + OH- = NH3↑ + H2O (A选项是错的)
EF段:氢氧化钠把氢氧化铝溶解:Al(OH)3 + NaOH = NaAlO2 + 2H2O
现在我们分段计算:
EF段: Al(OH)3 + NaOH = NaAlO2 + 2H2O
1 1
= 0.008mol 4mol/L * (36-34)mL
DE段:NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
1 1
=0.012mol 4mol/L * (34-31)mL
在计算CD段之前,我们先算铁元素的物质的量。
通过上面的计算,我们得出:溶液中NH4+的物质的量是0.012mol,从NO3-变成NH4+,一共转移的电子的物质的量是0.012mol * 8 = 0.096mol
铝的物质的量根据EF段的计算,是0.008mol,一共失去0.008mol * 3 = 0.024mol
所以铁失去的电子的总物质的量 = 0.096mol - 0.024mol = 0.072mol
得出:n(Fe) = 0.072mol / 3 = 0.024mol
B处的值,就是铝和铁的物质的量的和 = 0.024mol + 0.008mol = 0.032mol
铁和铝一共消耗的OH-的物质的量 = (0.024mol + 0.008mol) * 3 = 0.096mol
图象中C处的值 = 31mL - (0.096mol / 4mol/L) = 7mL
作如上分析,我们可以得出:
A选项,错的,正确反应是:NH4+ + H+ = NH3↑ + H2O
B选项,错的,没有产生气体(题目已知条件)
C正确
D选项,错,B处是0.032
上面的计算其实我们没有涉及到硝酸原浓度的计算,只是用排除法得到了C答案。下面我们来计算硝酸原溶液的浓度:
反应从头到尾,硝酸中的NO3-最终转化成两种形式:(1)NH3(2)NaNO3
所以硝酸的总物质的量 = n(NH3) + n(NaNO3)
= 0.012mol + 34mL * 4mol/L
= 0.148mol
上式解释:生成的氨气是0.012mol,在上面的计算中已经得出了结果。为什么硝酸钠用34mL的氢氧化钠来计算呢,因为图像中所有反应能产生硝酸钠的,就是从O点开始到E点。EF段是产生NaAlO2的,与硝酸根无关了。
c(HNO3) = 0.148mol / 100mL = 1.48mol/L
高三化学 复习是一项系统的学习工程,要提高复习效率,就需要注重 学习 方法 的探索,下面给大家分享一些关于高考化学答题技巧有哪些,希望对大家有所帮助。
高考化学答题技巧有哪些
1.选择题
在高考理综试卷中有8个化学单选题。解答时在认真审题的基础上仔细考虑各个选项,合理采用排除法、比较法、代入法、猜测法等方法,找到选项与题干,选项与选项之间区别联系,迅速的找到所要选项。选择题的答题方法是多样化的,最合理的方法可以把时间尽可能的压缩到最短,为解决后面的大题腾出更多时间。
2.填空题
按照近几年情况看,在高考理综试卷中化学题是四道填空题。一般来讲实验题、无机推断、有机推断、其他题目各一个。对于填空题在答题时有些共性的要求。
(1)化学方程式的书写要完整无误。
(2)专业用语不能错。
(3)当答案不唯一或有多种选择时,以最常见的方式作答不易失分。能用具体物质作答的要用具体物质作答,表达更准确。
(4)对于语言叙述性题目做答时要注意,从“已知”到“未知”之间的逻辑关系必须叙述准确,且环环相扣,才能保证不丢得分点,才能得满分。
(5)对于计算型填空,要注意该书写单位的要书写单位。
3.解答题
在解高考化学解答题时,语言文字的表达很重要。答题时内容要突出原理,层次分明,符合逻辑,文字精炼.若思路混乱,言不及题,词不达意,即使长篇大论也不得分,不按要求答题会失分,书写不规范也会失分。
高考化学解答题解题重要的不是技巧,而是应用数学思想方法进行化学计算:
(1)守恒法思想,包括元素守恒、质量守恒、电荷守恒、电子得失守恒。
(2)数轴法思想,两种物质之间发生反应时相对量不同,发生的反应不同这一类计算题。
高考化学复习四点建议
1.循序渐进,打好基础,辨析理清概念。
要根据自己的学习情况制定较好的 学习计划 ,使复习有计划、有目的地进行。既要全面复习,更要突出重点。要多看书,抓住教材中的主要知识精髓,特别是中学化学的核心内容,如物质结构、氧化还原反应、离子反应、元素化合物知识、电化学、化学实验、化学计算等。复习要注重基础,加强对知识的理解和能力的培养,力求做到“记住—理解—会用”。要针对自己的学习情况,查漏补缺,有重点有针对性地复习。
2.掌握原理,灵活应用,注重解题思路。
化学原理如元素守恒原则、氧化还原反应、电子得失守恒、化学平衡、物质结构、有机反应中断键成键的一般规律,要重点回顾。掌握化学基本原理和规律,在解题中灵活应用,拓宽解题思路,增强解题的技巧性。如应用守恒法、差量法、讨论法解一些计算题,可以提高解题的速率和准确性。推断有机物的结构,要抓住有机物官能团的转化规律和反应的基本类型。如有机物抓住烃、卤代烃、醇、醛、酸、酯的一系列变化关系。要通过复习提高灵活应用知识的能力,适当做一些综合性题,并储存在头脑中,高考时可以启发思维。要注重实验原理,高考化学实验题的比重较大,实验的复习要侧重于实验的基本操作,实验的分析、设计和评价,从“怎么做”到“为什么”,重视实验原理和实验方法,学会比较。如检测NaCl、Na2CO3混合物中Na2CO3的质量分数,可以用沉淀法、气体法和滴定法,比较可知滴定法最好。今年的高考题比较注重知识的实际应用,同时要求能够用准确的化学语言解释生活中的化学问题。
3.加强练习,温故知新,提高解题能力。
练习的方法较多,首先可以将做过的习题再有重点有选择地做一部分。其次要选好一本化学参考书,根据复习的进展,选做其中同步的习题。不要做一题对一题答案,应把一节或一单元做完再对答案,检查对错,加以订正,遇有不懂之处应通过一定的方式向同学或老师请教。还可以把今年各地的高考化学试题作为练习,检测一下自己目前的化学水平。练习时要注意分析解题的思路和方法。如针对物质结构中的“位、构、性”三者间的关系、等效平衡的应用、离子共存的条件、用守恒法解计算题等,多问为什么,不要陷入题海。做题可以检查对知识的把握程度,能开阔解题思路。
4.把握重点,消除盲点,切实做好纠错。
复习要突出重点、扫除盲点、加强弱点。分析近几年的高考化学试题,重点其实就是可拉开距离的重要知识点,即疑点和盲点;要走出“越基础的东西越易出错”的怪圈,除了思想上要予以高度重视外,还要对作业、考试中出现的差错,及时 反思 ,及时纠正;对“事故易发地带”有意识地加以强化训练。每一次练习或考试后,要对差错做出详尽的分析,找出错误原因。
高考化学的考试答题技巧 总结
认真审题
1、试卷几乎不会出现无用的干扰信息。考生要查看题目所给的信息是否都用上了,注意寻找明示或暗示问题思考的角度性信息。
2、注意关键词、实验目的等重要信息,以有效避免回读。比如是过量还是少量;是短周期还是前20号元素;是化合物还是单质或混合物;是烃还是烃的衍生物;是几滴还是几毫升等。
3、读工业流程题,可先采用诸葛亮奉行的“观其大略”,然后切入到问题,再带着问题精读精解。分析时,考生要根据目的,对比原料和目标物,思考元素的不同存在形式转化时,要加入哪些类型的试剂(酸性或碱性物质、氧化剂或还原剂、沉淀剂等),发生哪些类型的反应。
4、对定量实验题,要先看目的,根据测定的物理量,领会实验的原理、操作等。
5、对实验探究题,一讲逻辑,二讲论据。设计方案时,要分析变量是什么,是否要做到等浓度、等pH或等体积。
按照要求作答
1、要注意的答题要求是写“名称”还是“化学式”;是写有机物的“分子式”还是“结构简式”;是写“化学方程式”还是“离子方程式”;是写官能团还是含氧官能团;是写元素符号还是元素名称;是写等号还是可逆符号;是“由大到小”还是“由小到大”;是只答化学用语还是结合化学用语简答等。
2、作答简述题时,可模仿高考题的表达方式。如排除溶液稀释对颜色改变的影响;确认无--,排除其对--检验的干扰(或排除对-- 与--反应的干扰);用--替换--做上述--实验,对比现象等。对于说理论述题,考生要阐述解题的逻辑链条,不要缺省。
3、其他要注意的事项:书写热化学方程式,是否遗漏物质的状态、“+”“-”号、“kJ·mol-1”;反应方程式的条件是否书写正确;有机反应小分子产物是否漏写,有机物的结构简式是否多氢或少氢,聚合反应的几处n是否漏写;易错字书写是否正确,如油脂、酚醛树脂、坩埚、饱和、蘸取、蒸馏、萃取、静置、氨基、铵盐、石炭酸等。
合理分配时间
理综卷答题时间的分配很重要。考生做选择题要求稳,速度不能太快。对于难题,可暂且搁置,迂回作战。不要频繁看表,以避免不必要的慌乱。
高考化学答题技巧有哪些相关 文章 :
★ 高考化学有哪些答题技巧
★ 高考化学答题技巧及注意事项
★ 高考化学的答题技巧方法
★ 高考化学的答题技巧介绍
★ 化学高考大题答题技巧
★ 高考化学考试中答题技巧
★ 高考化学答题规范与技巧
★ 高考化学的解题技巧
★ 高考化学实验题型答题技巧
★ 最新高考理综化学答题技巧









